
Zusätzlich zu den oft diskutierten BRCA-Genmutationen gibt es eine beträchtliche Anzahl von andere vererbte Genmutationen, die das Brustkrebsrisiko erhöhen. Tatsächlich wird angenommen, dass Mutationen in über 100 Genen zum Risiko beitragen, und die Zahl der Nicht-BRCA-Genmutationen, die das Brustkrebsrisiko erhöhen, wird voraussichtlich zunehmen, wenn unser Wissen über die Genetik von Krebs zunimmt.
Zusätzlich zu BRCA1- und BRCA2-Genmutationen umfassen einige davon Mutationen in ATM, PALB2, PTEN, CDH1, CHEK2, TP53, STK11, PMS2 und mehr. Sehen wir uns an, wie wichtig diese Nicht-BRCA1/BRCA2-Mutationen bei familiärem Brustkrebs sind, und einige der Merkmale, die häufiger gefunden werden.
Es wird derzeit angenommen, dass 5 % bis 10 % der Brustkrebserkrankungen genetisch oder familiär bedingt sind ( obwohl sich diese Zahl ändern kann, wenn wir mehr erfahren), aber nicht alle dieser Krebsarten sind auf BRCA-Mutationen zurückzuführen.
Höchstens 29 % (und wahrscheinlich viel weniger) erbliche Brustkrebserkrankungen werden positiv auf BRCA1- oder BRCA2-Genmutationen getestet, und viele Menschen versuchen, sich auf die anderen bekannten genetischen Veränderungen zu testen.
Da die Wissenschaft hinter Erbkrebs sehr beängstigend, um nicht zu sagen verwirrend ist und unvollständig ist, ist es hilfreich, zunächst über die Biologie von Genmutationen zu sprechen und darüber, wie diese Veränderungen in der DNA eine Rolle bei der Entstehung von Krebs spielen.
Wenn man über Mutationen spricht, ist es wichtig, zwischen vererbten und erworbenen Genmutationen zu unterscheiden.
Erworbene oder somatische Genmutationen haben in den letzten Jahren viel Aufmerksamkeit erhalten, da diese Mutationen verursachen Veränderungen, die das Wachstum von Krebs antreiben. Zielgerichtete Therapien, also Medikamente, die auf bestimmte Wege im Zusammenhang mit diesen Veränderungen abzielen, haben die Behandlung einiger Krebsarten wie Lungenkrebs erheblich verbessert.
Erworbene Mutationen hingegen sind nicht von Geburt an vorhanden, sondern werden beliebig gebildet Zeit nach der Geburt im Prozess der Entwicklung einer Zelle zu einer Krebszelle. Diese Mutationen betreffen nur einige Zellen im Körper. Sie werden nicht von einem Elternteil geerbt, sondern "erworben", da die DNA in Zellen Schäden durch die Umwelt oder als Ergebnis der normalen Stoffwechselprozesse des Körpers ausgesetzt ist.
Vererbte oder Keimbahnmutationen sind im Gegensatz dazu genetische Veränderungen, die Menschen sind geboren und von einem oder beiden Elternteilen vererbt werden. Diese Mutationen betreffen alle Zellen des Körpers. Es sind diese vererbten Mutationen (und andere genetische Veränderungen), die die Wahrscheinlichkeit erhöhen können, dass eine Person an Krebs erkrankt, und für den sogenannten erblichen oder familiären Brustkrebs verantwortlich sind.
Erbliche (Keimbahn) vs. erworbene (somatische) GenmutationenViele Menschen fragen sich, wie genau ein abnormales Gen oder eine Kombination von Genen zu Brustkrebs führen kann , und eine kurze Erörterung der Biologie ist hilfreich, um viele der Fragen zu verstehen, z. B. warum nicht jeder, der diese Mutationen hat, an Krebs erkrankt.
Unsere DNA ist ein Bauplan oder Code, der zur Herstellung von Proteinen verwendet wird. Wenn die Karte oder der Code falsch ist (z. B. der „Schriftzug“ in einem bestimmten Gen), gibt er die falschen Anweisungen für die Synthese eines Proteins. Das abnorme Protein ist dann nicht mehr in der Lage, seine eigentliche Aufgabe zu erfüllen. Nicht alle Genmutationen erhöhen das Krebsrisiko, und die meisten tun es tatsächlich nicht. Mutationen in Genen, die für das Wachstum und die Teilung von Zellen verantwortlich sind, oder „Treibermutationen“, treiben das Wachstum von Krebserkrankungen voran. Es gibt zwei Haupttypen von Genen, die, wenn sie mutiert sind, zu unkontrolliertem Wachstum führen können, das als Krebs bekannt ist:Onkogene und Tumorsuppressorgene.
Einige der Gene, die mit einem höheren Brustkrebsrisiko in Verbindung gebracht werden, sind Tumorsuppressorgene. Diese Gene kodieren für Proteine, die DNA-Schäden in Zellen reparieren (Schäden durch Giftstoffe in der Umwelt oder die normalen Stoffwechselprozesse in Zellen), dazu dienen, Zellen zu eliminieren, die nicht repariert werden können, oder das Wachstum auf andere Weise regulieren. Die Gene BRCA1 und BRCA2 sind Tumorsuppressorgene.
Viele dieser Gene sind autosomal rezessiv, was bedeutet, dass jede Person eine Kopie davon erbt Gen von jedem Elternteil, und beide Kopien müssen mutiert werden, um das Krebsrisiko zu erhöhen. Vereinfacht bedeutet dies, dass eine Kombination aus genetischen und umweltbedingten Faktoren (eine erworbene Mutation im anderen Gen) zusammenwirken muss, um zur Entstehung von Krebs zu führen. Hinzu kommt, dass in der Regel mehrere Mutationen auftreten müssen, damit eine Zelle zu einer Krebszelle wird.
Was es bedeutet, eine genetische Prädisposition für Krebs zu habenNicht alle Genmutationen oder genetischen Veränderungen erhöhen das Brustkrebsrisiko in gleichem Maße , und dies ist ein wichtiges Konzept für alle, die Gentests in Betracht ziehen, zumal viele Menschen von dem sehr hohen Risiko gehört haben, das durch BRCA-Mutationen entsteht. Die Genpenetranz ist definiert als der Anteil der Menschen mit einer Mutation, bei denen die Erkrankung auftritt (in diesem Fall Brustkrebs).
Bei einigen Mutationen ist das Brustkrebsrisiko sehr hoch. Bei anderen erhöht sich das Risiko möglicherweise nur um den Faktor 1,5. Dies ist wichtig zu verstehen, wenn man über mögliche vorbeugende Optionen spricht.
Ein weiteres wichtiges Konzept, das für das Verständnis von Genetik und Krebs wichtig ist, obwohl es zu komplex ist, um es zu erforschen hier im Detail, ist das der Epigenetik. Wir haben gelernt, dass Veränderungen in der DNA, die keine Veränderungen in den Basenpaaren (Nukleotiden) oder den „Buchstaben“, die für ein Protein kodieren, mit sich bringen, bei der Entstehung von Krebs genauso wichtig sein können. Mit anderen Worten, anstelle von strukturellen Veränderungen im DNA-Rückgrat können molekulare Veränderungen auftreten, die die Art und Weise verändern, wie die Botschaft gelesen oder ausgedrückt wird.
BRCA-Genmutationen sind die bekannteste genetische Anomalie im Zusammenhang mit Brustkrebs, aber sie ist es Es ist klar, dass es Frauen gibt, die aufgrund ihrer Familienanamnese für Brustkrebs prädisponiert sind und deren Test negativ ist.
Eine Studie aus dem Jahr 2017 ergab, dass BRCA-Mutationen nur 9 % bis 29 % der erblichen Mutationen ausmachten Brustkrebs. Selbst als auf weitere 20 bis 40 bekannte Mutationen getestet wurde, wurden jedoch nur 4 % bis 11 % der Frauen positiv getestet. Mit anderen Worten, 64 % bis 86 % der Frauen mit Verdacht auf erblichen Brustkrebs wurden sowohl auf BRCA-Mutationen als auch auf 20 bis 40 andere negativ getestet.
Unser Wissen über Genmutationen, die das Brustkrebsrisiko erhöhen, ist noch unvollständig, aber jetzt wissen, dass es mindestens 72 Genmutationen gibt, die mit erblichem Brustkrebs in Verbindung gebracht werden. Es wird angenommen, dass diese Mutationen (und andere noch unentdeckte) für 70 % bis 90 % der erblichen Brustkrebserkrankungen verantwortlich sind, die negativ auf BRCA-Genmutationen getestet werden. Zur Beschreibung dieser anderen Mutationen wurde das Akronym BRCAX geprägt, das für nicht BRCA1- oder BRCA2-bedingten familiären Brustkrebs steht.
72 genetische Mutationen im Zusammenhang mit erblichem BrustkrebsDie folgenden genetischen Anomalien unterscheiden sich in ihrer Häufigkeit, die Höhe des damit verbundenen Risikos, die Art von Brustkrebs, mit der sie in Verbindung gebracht werden, und andere Krebsarten, die mit den Mutationen in Verbindung gebracht werden.
Die meisten dieser Brustkrebsarten haben ähnliche Merkmale (z. B. Krebsart, Östrogen- Rezeptorstatus und HER2-Status) bis hin zu nicht erblichem oder sporadischem Brustkrebs, aber es gibt Ausnahmen. Beispielsweise sind einige Mutationen stärker mit dreifach negativem Brustkrebs assoziiert, einschließlich Mutationen in BARD1 , BRCA1 , BRCA2 , PALB2 und RAD51D .
Nicht alle Menschen mit den folgenden Genmutationen sind gleich. Im Allgemeinen kann es Hunderte von Wegen geben, auf denen diese Gene mutiert werden. In einigen Fällen produziert das Gen Proteine, die das Tumorwachstum unterdrücken, aber die Proteine funktionieren nicht so gut wie das normale Protein. Bei anderen Mutationen wird das Protein möglicherweise überhaupt nicht produziert.
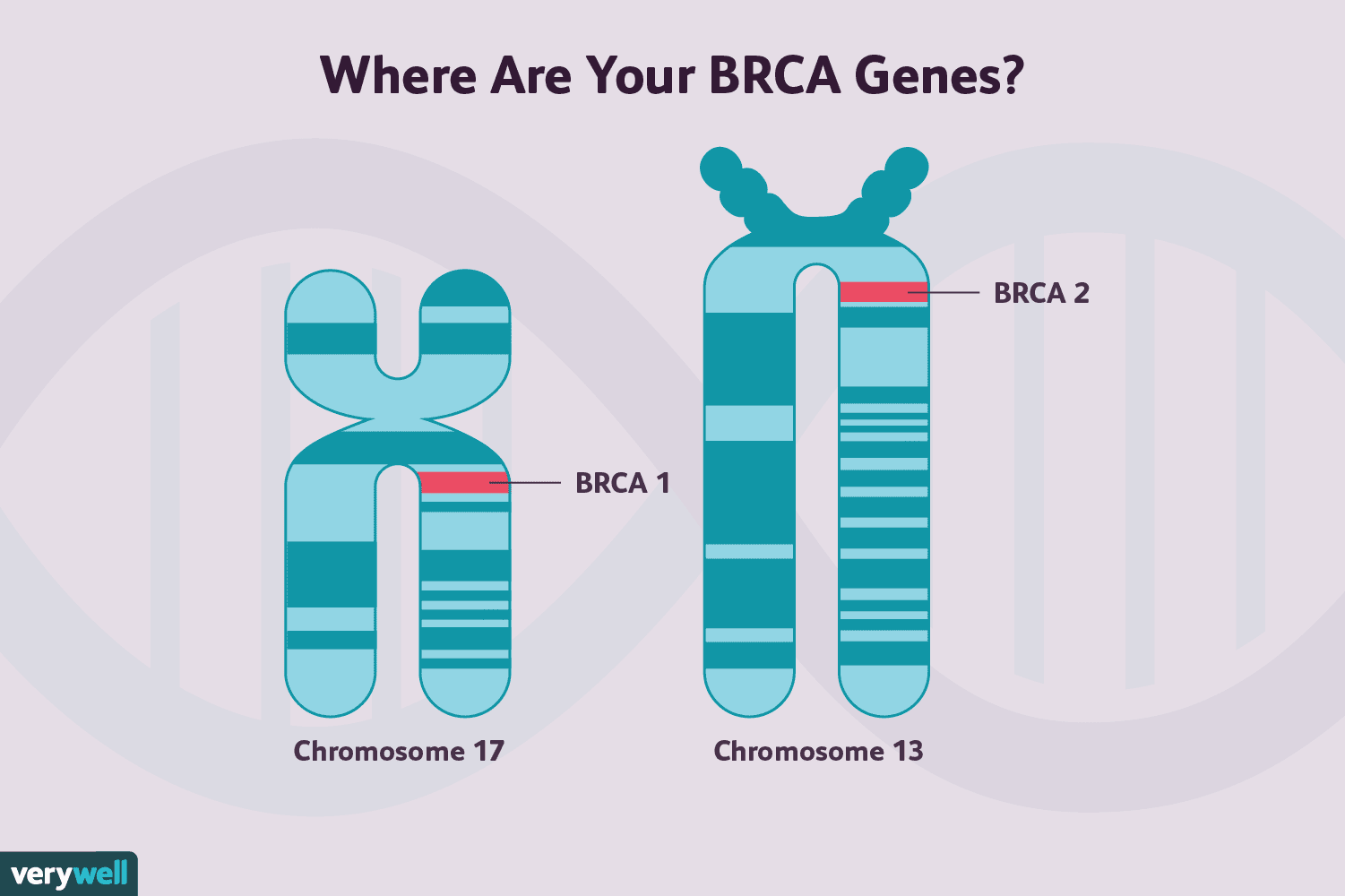
BRCA1-Genmutationen und BRCA2-Genmutationen sind beide mit einem erhöhten Entwicklungsrisiko verbunden Brustkrebs sowie einige andere Krebsarten, obwohl sich die beiden in diesem Risiko etwas unterscheiden.
Im Durchschnitt erkranken 72 % der Frauen mit BRCA1-Mutationen und 69 % der Frauen mit mutierten BRCA2-Genen im Alter von 80 Jahren an Brustkrebs.
Darüber hinaus können sich die mit diesen Mutationen assoziierten Brustkrebsarten unterscheiden. Brustkrebs bei Frauen mit BRCA1-Mutationen ist mit größerer Wahrscheinlichkeit dreifach negativ. Etwa 75 % sind Östrogenrezeptor-negativ, und sie sind auch weniger wahrscheinlich HER2-positiv. Sie haben auch eher einen höheren Tumorgrad. Brustkrebserkrankungen bei Frauen mit BRCA2-Mutationen ähneln dagegen Krebserkrankungen bei Frauen, die keine Trägerinnen der BRCA-Genmutation sind.
Das ATM-Gen kodiert für Proteine, die dabei helfen, die Wachstumsrate von Zellen zu kontrollieren. Sie helfen auch bei der Reparatur beschädigter Zellen (Zellen, die DNA-Schäden durch Toxine erlitten haben), indem sie Enzyme aktivieren, die diesen Schaden reparieren.
Diejenigen, die zwei Kopien des mutierten Gens haben, haben ein ungewöhnliches autosomal-rezessives Syndrom, bekannt als Ataxie-Teleangiektasie. Bei der Ataxie-Teleangiektasie erhöhen die defekten Proteine nicht nur das Krebsrisiko, sondern führen auch dazu, dass einige Zellen im Gehirn zu früh absterben, was zu einer fortschreitenden neurodegenerativen Erkrankung führt.
Menschen, die nur eine mutierte Kopie des Gens haben (ungefähr 1 % der Bevölkerung), haben ein lebenslanges Risiko von 20 % bis 60 %, an Brustkrebs zu erkranken.
Es wird angenommen, dass Menschen mit dieser Mutation schon in jungen Jahren für Brustkrebs prädisponiert sind , sowie zur Entwicklung von bilateralem Brustkrebs.
Brustkrebsvorsorge mit Brust-MRT wird ab dem 40. Lebensjahr empfohlen, und Frauen können dies wünschen vorbeugende Mastektomie in Betracht ziehen. Menschen mit einem mutierten ATM-Gen scheinen auch für Schilddrüsen- und Bauchspeicheldrüsenkrebs prädisponiert zu sein und strahlenempfindlicher zu sein.
Mutationen im PALB2-Gen sind auch eine wichtige Ursache für erblichen Brustkrebs. Das Gen PALB2 kodiert für ein Protein, das zusammen mit dem BRCA2-Protein beschädigte DNA in Zellen repariert. Insgesamt liegt das Lebenszeitrisiko für Brustkrebs mit einer PALB2-Mutation bei bis zu 58 %, obwohl dies je nach Alter variieren kann. Das Risiko beträgt das 8- bis 9-fache des Durchschnitts für Frauen unter 40 Jahren, aber etwa das 5-fache des Durchschnitts für Frauen über 60.
Von denjenigen, die eine Kopie des Gens tragen, entwickeln 14 % im Alter von 50 Jahren Brustkrebs und 35 % im Alter von 70 Jahren (weniger als bei BRCA-Mutationen).
Menschen, die eine PALB2-Mutation haben und an Brustkrebs erkranken, haben möglicherweise ein höheres Sterberisiko von der Krankheit.
Menschen, die 2 Kopien des mutierten PALB2-Gens erben, haben eine bestimmte Art von Fanconi-Anämie durch sehr niedrige Anzahl von roten Blutkörperchen, weißen Blutkörperchen und Blutplättchen.
Das CHEK2-Gen kodiert für ein Protein, das aktiviert wird, wenn DNA beschädigt wird. Es aktiviert auch andere Gene, die an der Zellreparatur beteiligt sind.
Das lebenslange Risiko für Träger von CHEK2-verkürzenden Mutationen beträgt 20 % für eine Frau mit Nr betroffenen Verwandten, 28 % für eine Frau mit einem betroffenen Verwandten zweiten Grades, 34 % für eine Frau mit einem betroffenen Verwandten ersten Grades und 44 % für eine Frau mit einem betroffenen Verwandten ersten und zweiten Grades.
Bei Männern und Frauen erhöht das Gen auch das Risiko für Dickdarmkrebs und nicht -Hodgkin-Lymphom.
Mutationen in CDH1 verursachen einen Zustand, der als erbliches Magenkrebssyndrom bekannt ist.
Menschen, die dieses Gen erben, haben ein lebenslanges Risiko von bis zu 80 %, an Magenkrebs zu erkranken, und von bis zu 52 %, an lobulärem Brustkrebs zu erkranken.
Das Gen kodiert für ein Protein (epitheliales Cadherin), das den Zellen hilft, aneinander zu haften (Einer der Unterschiede zwischen Krebszellen und normalen Zellen besteht darin, dass Krebszellen diese Adhäsionschemikalien fehlen, die sie haften lassen). Krebs bei Menschen, die diese Mutation erben, metastasiert eher.
Mutationen im PTEN-Gen sind eine der häufigeren Tumorsuppressorgen-Mutationen. Das Gen kodiert für Proteine, die das Zellwachstum regulieren und den Zellen helfen, zusammenzuhalten.
Mutationen im Gen scheinen das Risiko zu erhöhen, dass Krebszellen von einem Tumor abbrechen und Metastasierung. PTEN ist mit einem Syndrom namens PTEN-Hamartom-Tumor-Syndrom sowie mit dem Cowden-Syndrom assoziiert.
Frauen, die eine PTEN-Mutation tragen, haben ein lebenslanges Brustkrebsrisiko von bis zu 85 % und ein erhöhtes Risiko für gutartige Brustveränderungen wie fibrozystische Erkrankungen, Adenose und intraduktale Papillomatose.
Die Mutationen sind auch mit einem erhöhten Risiko für Gebärmutterkrebs (und gutartige Uterusmyome) verbunden ), Schilddrüsenkrebs, Dickdarmkrebs, Melanom und Prostatakrebs.
Nicht krebsbedingte Symptome umfassen eine große Kopfgröße (Makrozephalie) und die Tendenz, sich zu bilden gutartige Tumore, bekannt als Hamartome.
Mutationen in STK11 sind mit einer genetischen Erkrankung verbunden, die als Peutz-Jegher-Syndrom bekannt ist. STK11 ist ein Tumorsuppressorgen, das am Zellwachstum beteiligt ist.
Zusätzlich zu einem erhöhten Brustkrebsrisiko (mit einem Lebenszeitrisiko von bis zu 50 %) birgt das Syndrom ein erhöhtes Risiko für viele Krebsarten, darunter Darmkrebs, Bauchspeicheldrüsenkrebs, Magenkrebs, Eierstockkrebs, Lungenkrebs, Gebärmutterkrebs und mehr.
Zu den mit der Mutation verbundenen, nicht krebsbedingten Zuständen gehören gutartige Polypen im Verdauungstrakt und Harnsystem, Sommersprossen im Gesicht und im Inneren des Mundes und mehr. Brustkrebs-Screening wird oft für Frauen ab 20 empfohlen, oft mit MRT mit oder ohne Mammographie.
Das TP53-Gen kodiert für Proteine, die das Wachstum abnormaler Zellen stoppen.
Diese Mutationen sind sehr häufig bei Krebserkrankungen erworben Mutationen im p53-Gen werden bei etwa 50 % der Krebserkrankungen gefunden.
Erbliche Mutationen sind weniger häufig und mit Erkrankungen verbunden, die als Li-Fraumeni-Syndrom bekannt sind, oder Li-Fraumeni-ähnliches Syndrom (das ein geringeres Krebsrisiko hat). Die Mehrheit der Menschen, die die Mutation erben, entwickeln im Alter von 60 Jahren Krebs und neigen zusätzlich zu Brustkrebs zu Knochenkrebs, Nebennierenkrebs, Bauchspeicheldrüsenkrebs, Dickdarmkrebs, Leberkrebs, Hirntumoren, Leukämie und mehr. Es ist nicht ungewöhnlich, dass Menschen mit der Mutation mehr als einen primären Krebs entwickeln.
Es wird angenommen, dass vererbte Mutationen im p53-Gen für etwa 1 % der Fälle verantwortlich sind erblicher Brustkrebs. Mit der Mutation assoziierte Brustkrebsarten sind häufig HER2-positiv und weisen einen hohen Tumorgrad auf.
Lynch-Syndrom oder erblicher Darmkrebs ohne Polyposis ist mit Mutationen in mehreren verschiedenen Genen verbunden einschließlich PMS2, MLH1, MSH2, MSH6 und EPCAM.
Insbesondere PMS2 wurde mit einem doppelt so hohen Brustkrebsrisiko in Verbindung gebracht. Das Gen fungiert als Tumorsuppressorgen und kodiert für ein Protein, das beschädigte DNA repariert.
Neben Brustkrebs bergen diese Mutationen ein hohes Risiko für Dickdarmkrebs , Eierstock, Gebärmutter, Magen, Leber, Gallenblase, Dünndarm, Niere und Gehirn.
Es gibt mehrere andere Genmutationen, die mit einem erhöhten Risiko für Brustkrebs verbunden sind, und Es wird erwartet, dass in naher Zukunft weitere entdeckt werden. Einige davon sind:
Derzeit sind Tests für BRCA-Genmutationen sowie für Mutationen verfügbar ATM, CDH1, CHEK2, MRE11A, MSH6, NBN, PALB2, PMS2, PTEN, RAD50, RAD51C, SEC23B und TP53, wobei dieser Bereich voraussichtlich in naher Zukunft dramatisch expandieren wird.
Die Verfügbarkeit dieser Tests wirft jedoch viele Fragen auf. Wer könnte zum Beispiel erblichen Brustkrebs haben und wer sollte getestet werden? Was sollten Sie tun, wenn Sie positiv auf eines dieser Gene getestet werden?
Idealerweise sollten alle Tests nur mit der Anleitung und Hilfe eines genetischen Beraters durchgeführt werden . Dafür gibt es zwei Gründe.
Einer davon ist, dass es niederschmetternd sein kann zu erfahren, dass Sie Träger einer Mutation sind, die zunehmen kann Ihres Risikos, und die Anleitung durch jemanden, der die empfohlenen Management- und Vorsorgeuntersuchungen kennt, ist von unschätzbarem Wert.
Wie bereits erwähnt, bringen einige Mutationen ein hohes und andere ein viel geringeres Risiko mit sich. Einige Mutationen könnten früher im Leben (z. B. in Ihren 20ern) von größerer Bedeutung sein, während andere möglicherweise kein frühes Screening erfordern. Ein genetischer Berater kann Ihnen helfen, herauszufinden, was derzeit in Bezug auf das Screening auf Ihre spezielle Mutation empfohlen wird, während Sie andere Risikofaktoren berücksichtigen, die Sie möglicherweise haben.
Der andere Grund, warum genetische Beratung so wichtig ist, ist, dass Sie möglicherweise ein erhebliches Risiko haben Brustkrebs entwickeln, auch wenn Ihre Tests negativ sind. Es gibt noch viel zu lernen, und ein genetischer Berater kann Ihnen helfen, Ihre Familienanamnese zu untersuchen, um festzustellen, ob Sie trotz negativer Tests ein hohes Risiko tragen, und das Screening entsprechend zu planen.
Gentests für BrustkrebsSo wie Menschen, bei denen Brustkrebs diagnostiziert wurde, brauchen auch diejenigen, die Gene tragen, Unterstützung die das Risiko erhöhen, brauchen Unterstützung. Glücklicherweise gibt es Organisationen, die sich speziell darauf konzentrieren, Menschen in dieser Situation zu unterstützen.
Eine Organisation, FORCE, ein Akronym für Facing Our Risk of Cancer Empowered, bietet eine Hotline, ein Message Board und Informationen für diejenigen, die an erblich bedingtem Krebs erkrankt sind.
Andere Organisationen und Unterstützungsgemeinschaften stehen zur Verfügung, um Menschen bei der Bewältigung der Entscheidungen im Zusammenhang mit a Diagnose von erblich bedingtem Brustkrebs.
Der Begriff „Previvorer“ wurde von FORCE geprägt, um Menschen zu beschreiben, die eine Veranlagung überleben zu Brustkrebs. Wenn Sie sich dieser Situation gegenübersehen, sind Sie nicht allein, und mit dem Hashtag #previvor finden Sie viele andere auf Twitter und anderen sozialen Medien.
Es kann überwältigend sein, etwas über die vielen verschiedenen Genmutationen zu erfahren, die das Brustkrebsrisiko erhöhen über BRCA-Mutationen hinaus, aber diese "anderen" Mutationen sind von erheblicher Bedeutung, da bekannt ist, dass BRCA-Mutationen für eine relative Minderheit von familiärem Brustkrebs verantwortlich sind. Gleichzeitig steckt die Wissenschaft, die sich mit erblich bedingtem Brustkrebs befasst, noch in den Kinderschuhen, und es gibt noch viel zu lernen. Wenn Sie befürchten, dass Sie eine Mutation haben oder erfahren haben, dass Sie eine haben, ist es hilfreich, so viel wie möglich zu lernen. Erbkrebsorganisationen wie FORCE können Ihnen nicht nur weitere Informationen zur Verfügung stellen, sondern Ihnen auch helfen, mit anderen in Kontakt zu treten, die vor einer Reise mit ähnlichen Fragen und Bedenken stehen.